|
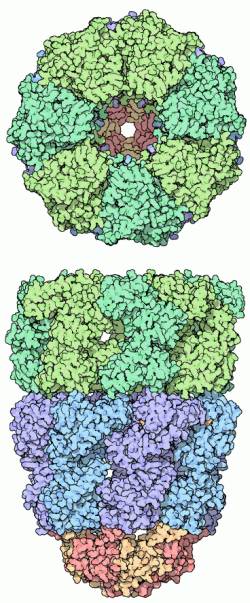
Chaperony - tłumaczenie z PDBJak można zauważyć patrząc na wiele struktur w Protein Data Banku, najbardziej aktywne białka mają stabilną, globularną strukturę. Jednakże, białka są budowane jako bezkształtne łańcuchy, łączone ze sobą po jednym aminokwasie w rybosomach. Większość łańcuchów białek następnie fałduje się spontanicznie w strukturę finalną, powodowane potrzebą ukrywania ich hydrofobowych części od otaczającej wody. Jednakże niektóre - duże białka lub białka z wieloma domenami - potrzebują odrobiny pomocy. W trakcie fałdowania się w złożony kształt mogą utknąć gdzieś po drodze. NIEBEZPIECZEŃSTWO ZŁEGO SFAŁDOWANIA Nie jest to banalny problem. Komórki nie mogą czekać w nieskończoność na poprawne sfałdowanie białek. Źle sfałdowane białka często posiadają reszty hydrofobowe na ich powierzchni zamiast bezpiecznego ukrycia ich w środku. Te hydrofobowe fragmenty mocno asocjują z podobnymi fragmentami na innych cząsteczkach białek, tworząc duże agregaty. Przypadkowe agregaty są śmiertelne dla komórek: takie choroby jak (sickle cell anemia), choroba szalonych krów i choroba Alzheimera są spowodowane przez nienaturalną agregację białek w rozsadzające komórki włókna PRZEWODNICY PO ŚCIEŻCE FAŁDOWANIA Chaperony to białka, które prowadzą cząsteczki białek przez złożony proces fałdowania. Ochraniają białka w trakcie tego procesu, osłaniając je od innych białek, z którymi mogłyby się związać i zakłocić proces. Wiele białek chaperonowych określa się terminem białka szoku cieplnego (z nazwami typu HSP-60 "Heat Schock Protein") ponieważ są produkowane w dużych ilościach podczas gdy komórka jest wystawiona na działanie ciepła. Ciepło, w ogólności, destabilizuje białko zwiększa częstotliwość nieprawidłowego sfałdowania. Tak więc, gdy robi się naprawdę gorąco komórki potrzebują dodatkowej pomocy dla swoich białek. CHAPERONY HSP-60 Jeden robiący wrażenie rodzaj chaperonów tworzy zamknięte środowisko dla fałdowania się białek, które to całkowicie ochrania je w trakcie fałdowania. Kompleks GroEL - GroES pochodzacy z bakteri Pałeczki Okrężnicy (Escherichia Coli) jest przedstawionyu poniżej. Pochodzi on z wpisu 1aon z PDB. Kompleks ten składa się dwóch połączonych pierścieni stworzonych z białek GroEL, zaznaczonych tutaj na niebiesko i zielono oraz czapeczki po jednej stronie złożonej z białek GroES, pokolorowanych na czerwono i żółto na spodzie. Jak można zauważyć na widoku z góry, siedem białek GroEL tworzy pierścień z przestrzenią rozmiarów białek w środku. Niesfałdowane białka wchodza do tej przestrzeni i fałdują się w środku. 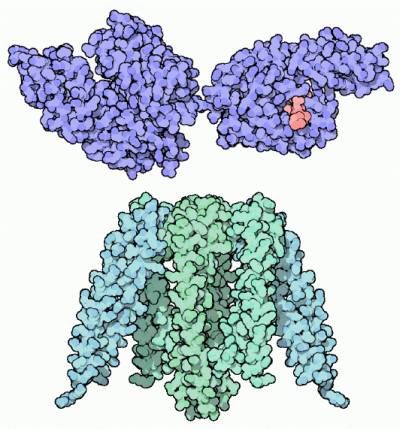
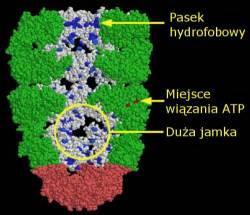
HSP-70 I PREFAŁDOWANIE Mniejsze Chaperony ochraniają białka w momencie zaraz po opuszczeniu rybosomu. Na tym etapi ich struktura jest w bardzo niewielkim stopniu pofałdowana, tak że rozciągnięte odcinki z wieloma wyeksponowanymi obszarami hydrofobowymi są szczególnie podatne na agregację. HSP-70 pokazane na górze odnajdują te rozciągnięte odcinki i wiążą się do nich, osłaniając je przed sąsiadami. Następnie zasilane przez ATP, chaperony uwalnia łańcuch, gdy ten jest gotów do fałdowania. HSP-70 składa się z dwóch domen: jednej, która wiąże ATP i kontroluje cały proces, pokazanej z lewej strony białka z wpisu PDB 1dkg oraz jednej, która wiąże hydrofobowe peptydy, przedstawiona tutak po prawej stronie (wpis PDB 1dkz). Mały peptyd, zaznaczony na różowo, jest związany w szczelinie wiążącej wewnątrz białka. Dziwaczne meduzokształtna prefoldyna, ukazana na dole (wpis PDB 1fxk), przeprowadza podobny proces pochłaniania łańcuchów białek, gdy te sie fałdują. ODKRYWANIE STRUKTURY Duże kompleksy GroEL-GroES są dostępne w PDB wpis 1aon. Na tym rysunku, trzy z podjednostek w każdym pierścieniu GroEL zostały usunięte by pokazać wnętrze, pozostawiając cztery podjednostki w każdym kręgu. Na dwóch z tyłu aminokwasy bogate w węgiel, leucyna, izoleucyna, walina, metionina, fenyloalanina, tyrozyna oraz tryptofan są zaznaczone na niebiesko. Zwróć uwagę na pasek hydrofobowych aminokwasów dookoła wejścia do jamki. Oddziałują one mocno z niesfałdowanymi białkami wpychając je do jamki. Teraz zwróć uwagę na spodnią jamkę zaczopowaną przez zaznaczoną na różowo jednostkę GroES. Zasilany przez ATP (ADP można odnaleźć w tej strukturze zaznaczone na jaskrawo czerwono), pierścień GroEL ulega poważnym zmianom kształtu. Jamka jest znacznie większa a pasek hydrofobowych aminokwasów jest oddzielony od jamki. Zmusza to łańcuch białka uwięziony wewnątrz do fałdowania się według własnego uznania, dając mu wiele wymaganej przestrzeni. Obrazki i tekst: David S. Goodsell Tłumaczenie: Moshchu 1 |